Чего ждать от нового метода клонирования людей

«Сознание того, что он жив, несмотря на то что умер много столетий назад, было само по себе большим испытанием. Тлейлаксианцы взяли клетки его мертвой плоти и вырастили существо в одном из своих чанов. Эти клетки начали размножаться и превратились в существо, имеющее его нынешнее тело». Все гхолы Дункана Айдахо (а их у Бога-императора Дюны, прожившего больше трех тысяч лет, было немало) сложно переживали тот факт, что они - клоны. В конце 1960-х, когда Фрэнк Герберт придумывал для вселенной Дюны тлейлаксианские аксолотль-чаны, результаты первых экспериментов по созданию генетических копий животных были уже опубликованы. Но работало клонирование совсем не так, как у Бене Тлейлаксу. На то, чтобы воспроизвести технологию из книг Герберта, ученым потребовалось больше полувека - и сейчас они почти у цели...
Динозавры из лягушек
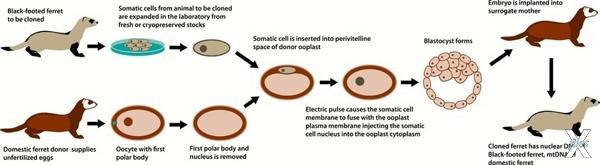
То, что сделал в 1958 году Джон Гердон, не было похоже на размножение клеток мертвой плоти. Его метод был гораздо ближе к тому, что делали в «Парке Юрского Периода» (который написали на несколько десятилетий позже), где динозавров выращивали из обломков их ДНК, «забивая» недостающие сегменты генами птиц, рептилий и земноводных.
У исходного организма — в первых экспериментах Гердона это был головастик — ученый брал лишь ядро одной из клеток, например, из стенки кишечника. Затем это ядро он подсаживал внутрь яйцеклетки, взятой от другой лягушки — и наблюдал за развитием головастика. Родное ядро яйцеклетки он при этом даже не удалял — потому что заметил, что в такой ситуации оно уступает руководство развитием подсаженному ядру. Убирать генетический материал донора ученые начали позже, когда речь зашла о полноценном клонировании животных.
Предшественники Гердона придумали метод переноса ядер совсем для других целей. Они подозревали, что по мере развития организма его клетки теряют «перспективность» — способность превращаться в разные клеточные типы. Пересадка ядра в яйцеклетку позволяла проверить эту гипотезу. Выяснилось, что если перенести в яйцеклетку ядро из клетки раннего зародыша, то у нее больше шансов развиваться нормально, чем если ядро взяли из клетки позднего зародыша — тогда почти точно ничего не получится.
Но Гердон обнаружил, что дело не столько в «сроке годности» клетки, сколько в недоработках метода. В его руках технология заработала с ядрами практически любого возраста — и тем самым превратилась в первый способ клонирования животных.
Клонировать млекопитающих взялись в середине 1990-х — и вскоре после этого договорились о том, что с людьми этого пробовать не будут. Поэтому даже не пришлось всерьез обсуждать, будет ли результат таких экспериментов настоящим клоном — вроде того, о котором писал Герберт. В методе Гердона есть один важный изъян: для того, чтобы вырастить клона, одного лишь ядра человеческой клетки недостаточно. Нужно найти еще женщину, которая станет донором яйцеклетки. А сама по себе ДНК не способна ни размножаться, ни развиваться — в соответствии с принципом XIX века: omnis cellula e cellula, клетка происходит только от клетки.
Поэтому в клетках клонов должна была с неизбежностью оказаться и чужеродная ДНК — из митохондрий материнской яйцеклетки. И хотя митохондриальные гены составляют лишь доли процента от общего клеточного генома, мы не смогли бы назвать таких людей точными генетически копиями оригинала.
Ребенку нужна бластоциста
Когда эксперименты с клонированием начались на млекопитающих, стало ясно, что в своих предположениях о «перспективности» ядер ученые в чем-то были правы. Забирая ядро из взрослого организма, мы переносим в будущий клон мутации, которые накопились в ДНК за годы жизни оригинала, и другие признаки генетического (и эпигенетического) возраста. И хотя мы до сих пор не знаем наверняка, повышает ли это «стартовый» возраст клона, известно, что многие такие клоны живут недолго. Овечка Долли, например, прожила в два раза меньше, чем положено обычной овце. А первых клонированных обезьян удалось получить только из ядер зародышевых клеток — клоны, полученные переносом «взрослых» ядер доживали лишь до появления на свет.
Чтобы научиться получать зародышевые клетки без помощи яйцеклеток, японец Синъя Яманака в 2006 году предложил технологию клеточного репрограммирования. Оказалось, что достаточно подействовать на клетки всего несколькими белками (или запустить работу соответствующих им генов), чтобы «обнулить» возраст клетки и превратить ее в эмбриональную стволовую, потенциальный источник любых клеток в организме.
Спустя шесть лет Яманаке, а по старой памяти и Гердону, присудили Нобелевскую премию. Официально — «за репрограммирование взрослых клеток в плюрипотентные», что можно прочесть как «за технологии клонирования». Берем клетку взрослого организма, превращаем ее в зародышевую, размножаем и получаем клеточную массу, из которой можно вырастить любой участок зародыша — как это еще назвать?
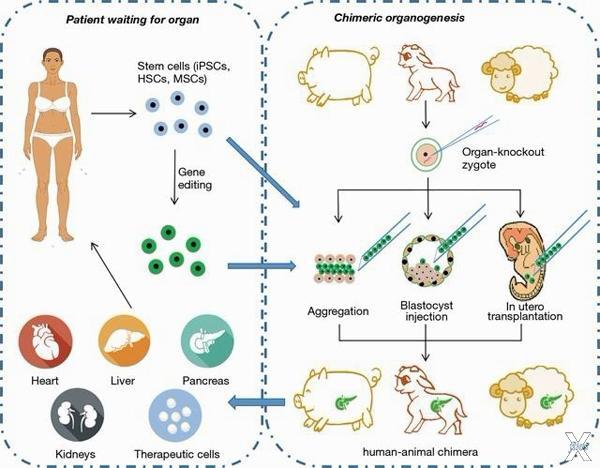
Выращивание отдельных частей организма — например, участка кожи или роговицы — из репрограммированных клеток сегодня так и называют: терапевтическое клонирование. Тем самым подчеркивая, что речь идет не о полноценных клонах, а лишь о методе лечения, когда человек становится источником запасных частей для самого себя. Для создания настоящих клонов есть отдельный термин — репродуктивное клонирование, и как раз оно сейчас запрещено.
Но даже если бы кто-нибудь сегодня отважился клонировать человека по методу Яманаки, ему все равно не удалось бы обойтись одной-единственной клеткой оригинала. Подобно тому, как клеточному ядру для развития было необходимо попасть в «тело» яйцеклетки, эмбриональные (и в том числе репрограммированные) клетки не могут расти без внезародышевых оболочек — амниона, аллантоиса и плаценты. Они нужны, чтобы прикрепить будущий зародыш к стенке матки, снабжать его едой и кислородом, а главное — сигналами о том, где у него, например, верхняя и нижняя сторона. Лишенные этой информации клетки зародыша вынуждены лепить из себя будущее существо вслепую — и у них никогда не получается принять форму эмбриона человека.
Поэтому репрограммированные клетки пришлось бы подсадить в уже существующий эмбрион на стадии бластоцисты, когда внезародышевые клетки уже образовали клеточный шар. В результате у вас получился бы гибрид: внезародышевые ткани от одного организма, а зародыш — от другого. Эта конструкция больше похожа на то, что происходит в фильме «Чужой: Воскрешение», когда клон Эллен Рипли раз за разом вырастает химерой, из которой не получается отделить гены Чужого. Насколько «скрещивание» эмбрионов сказалось бы на генетической идентичности человеческого клона мы, к счастью, не знаем — но допускаем, что чужеродная ДНК могла бы попасть внутрь зародышевых клеток. И неизвестно, удалось бы тогда ее отделить от собственных генов клона.
Как сделать гхолу
Клоны, которых мы могли бы создавать по методу Гердона или Яманаки, были бы «несамостоятельными». Биоматериала, забранного у оригинала, не хватало бы на то, чтобы вырастить полноценную копию. Чтобы реализовать предсказание Герберта, не хватало следующего шага: научиться превращать одну клетку взрослого организма в несколько типов клеток сразу — зародышевые и внезародышевые — и склеивать их в единую конструкцию.
Первым эту проблему решил в 2019 году испанский биолог Хуан Карлос Исписуа Бельмонте, известный своими смелыми экспериментами (среди других его заслуг, например, создание химерных зародышей человека и обезьяны). Он брал клетку из организма взрослой мыши, репрограммировал ее, размножал и получал культуру зародышевых стволовых клеток. Затем он репрограммировал их еще «дальше», откатывая к состоянию, когда из клетки может получиться или зародыш, или внезародышевая ткань. А потом на культуру таких клеток действовал смесью сигнальных веществ: одни заставляли клетки стать зародышевыми, а другие — внезародышевыми. Получалась смесь, из которой вырастало нечто, похожее на бластоцисту — бластоид — и его даже удавалось имплантировать в мышиную матку. Так у Бельмонте сложился третий способ клонирования животных.
Теперь его успехи удалось повторить и с клетками людей. Причем это сделали одновременно сразу три группы. Исследователи из Австралии и Техаса опубликовали свое отчеты в новом номере Nature, а ученые из Калифорнийского технологического университета пока только выложили препринт на портал biorXiv — зато успели на несколько дней раньше.
Их методы незначительно различаются между собой, но в основе их одна и та же идея: репрограммировать клетки, подействовать на них разными сигнальными веществами и собрать в бластоид на трехмерной подложке. У всех исследовательских групп получились конструкции, которые по морфологии и экспрессии генов напоминали человеческие бластоцисты. А поскольку проверять их жизнеспособность имплантацией в матку запрещено законом, ученым пришлось имитировать имплантацию in vitro — это, конечно, еще не аксолотль-чаны Бене Тлейлаксу, но логика та же.
На этом месте в экспериментах с зародышами возникают неизбежные трудности: их нельзя культивировать дальше 14-го дня развития (о том, почему это так, мы подробно рассказывали в материале «14 дней спустя»). А поскольку бластоид — это не настоящая бластоциста, то не очень понятно, какому дню развития он соответствует и в какой момент стоит остановить эксперимент. Поэтому обе группы продержали свои бластоиды в течение трех-четырех дней после имплантации и завершили эксперимент. Однако они успели заметить, что их искусственные эмбрионы проходят примерно те же стадии развития, которые положено пройти настоящим зародышам в утробе матери.
Как и положено свежей технологии, «тлейлаксианский» метод клонирования пока выглядит довольно сырым. Бластоиды получаются не каждый раз, в них не всегда появляются все необходимые типы клеток, а их геометрию непросто контролировать. Наконец, пока не родилась даже первая мышь, клонированная новым способом — что уж говорить о человеке. Тем не менее, у разработчиков большие планы на будущее. Они обещают отточить технологию до такой степени, чтобы бластоиды стали идентичны человеческим бластоцистам (и на них можно было, например, изучать последствия генетической модификации) — и прозрачно намекают: создание таких зародышей потребует пересмотра нынешнего законодательства об экспериментах над эмбрионами.
Это законодательство и без того нуждается в пересмотре, и Международное общество исследования стволовых клеток обещает опубликовать новую версию рекомендаций этой весной. Однако, как отмечают авторы редакционной заметки в Nature, эксперименты над искусственными эмбрионами могут вызывать меньше сочувствия публики, чем манипуляции с настоящими зародышами — хотя, если по строению они окажутся идентичны, у них будут точно так же биться сердца, двигаться диафрагма и передаваться нервные импульсы. Придется ли для них прописывать отдельные правила или ученые договорятся обращаться со всеми эмбрионами одинаково, вне зависимости от их происхождения?
Когда Пол Атрейдес впервые встречается с гхолой своего погибшего друга и учителя Дункана Айдахо, он колеблется. Перед ним стоит не Айдахо, но его тело. В долгу ли он перед искусственно созданной плотью, «в которой ложь мешается с истиной»? Сегодня, когда мы вплотную приблизились к созданию того, что могло бы быть настоящим гхолой, вопрос о том, что намешано в плоти, встает и перед нами. И по мере того, как методы клонирования будут совершенствоваться, нам придется пересматривать не только свое представление о том, где начинается неповторимость человека (которую уже не получится определять через сумму его генов), но о том, где начинается его жизнь — особенно тем из нас, кто отсчитывает ее от встречи сперматозоида с яйцеклеткой.
Динозавры из лягушек
То, что сделал в 1958 году Джон Гердон, не было похоже на размножение клеток мертвой плоти. Его метод был гораздо ближе к тому, что делали в «Парке Юрского Периода» (который написали на несколько десятилетий позже), где динозавров выращивали из обломков их ДНК, «забивая» недостающие сегменты генами птиц, рептилий и земноводных.
У исходного организма — в первых экспериментах Гердона это был головастик — ученый брал лишь ядро одной из клеток, например, из стенки кишечника. Затем это ядро он подсаживал внутрь яйцеклетки, взятой от другой лягушки — и наблюдал за развитием головастика. Родное ядро яйцеклетки он при этом даже не удалял — потому что заметил, что в такой ситуации оно уступает руководство развитием подсаженному ядру. Убирать генетический материал донора ученые начали позже, когда речь зашла о полноценном клонировании животных.
Предшественники Гердона придумали метод переноса ядер совсем для других целей. Они подозревали, что по мере развития организма его клетки теряют «перспективность» — способность превращаться в разные клеточные типы. Пересадка ядра в яйцеклетку позволяла проверить эту гипотезу. Выяснилось, что если перенести в яйцеклетку ядро из клетки раннего зародыша, то у нее больше шансов развиваться нормально, чем если ядро взяли из клетки позднего зародыша — тогда почти точно ничего не получится.
В результате переноса ядер получаются химеры: в них митохондрии от одного организма, а ядерные гены - от другого
Но Гердон обнаружил, что дело не столько в «сроке годности» клетки, сколько в недоработках метода. В его руках технология заработала с ядрами практически любого возраста — и тем самым превратилась в первый способ клонирования животных.
Клонировать млекопитающих взялись в середине 1990-х — и вскоре после этого договорились о том, что с людьми этого пробовать не будут. Поэтому даже не пришлось всерьез обсуждать, будет ли результат таких экспериментов настоящим клоном — вроде того, о котором писал Герберт. В методе Гердона есть один важный изъян: для того, чтобы вырастить клона, одного лишь ядра человеческой клетки недостаточно. Нужно найти еще женщину, которая станет донором яйцеклетки. А сама по себе ДНК не способна ни размножаться, ни развиваться — в соответствии с принципом XIX века: omnis cellula e cellula, клетка происходит только от клетки.
Поэтому в клетках клонов должна была с неизбежностью оказаться и чужеродная ДНК — из митохондрий материнской яйцеклетки. И хотя митохондриальные гены составляют лишь доли процента от общего клеточного генома, мы не смогли бы назвать таких людей точными генетически копиями оригинала.
Ребенку нужна бластоциста
Когда эксперименты с клонированием начались на млекопитающих, стало ясно, что в своих предположениях о «перспективности» ядер ученые в чем-то были правы. Забирая ядро из взрослого организма, мы переносим в будущий клон мутации, которые накопились в ДНК за годы жизни оригинала, и другие признаки генетического (и эпигенетического) возраста. И хотя мы до сих пор не знаем наверняка, повышает ли это «стартовый» возраст клона, известно, что многие такие клоны живут недолго. Овечка Долли, например, прожила в два раза меньше, чем положено обычной овце. А первых клонированных обезьян удалось получить только из ядер зародышевых клеток — клоны, полученные переносом «взрослых» ядер доживали лишь до появления на свет.
Чтобы научиться получать зародышевые клетки без помощи яйцеклеток, японец Синъя Яманака в 2006 году предложил технологию клеточного репрограммирования. Оказалось, что достаточно подействовать на клетки всего несколькими белками (или запустить работу соответствующих им генов), чтобы «обнулить» возраст клетки и превратить ее в эмбриональную стволовую, потенциальный источник любых клеток в организме.
Возможная стратегия применения репрограммированных клеток: клетки взрослого человека превращают в зародышевые, подсаживают в бластоцисту другого вида и выращивают внутри животного запасной орган для человека внутри
Спустя шесть лет Яманаке, а по старой памяти и Гердону, присудили Нобелевскую премию. Официально — «за репрограммирование взрослых клеток в плюрипотентные», что можно прочесть как «за технологии клонирования». Берем клетку взрослого организма, превращаем ее в зародышевую, размножаем и получаем клеточную массу, из которой можно вырастить любой участок зародыша — как это еще назвать?
Выращивание отдельных частей организма — например, участка кожи или роговицы — из репрограммированных клеток сегодня так и называют: терапевтическое клонирование. Тем самым подчеркивая, что речь идет не о полноценных клонах, а лишь о методе лечения, когда человек становится источником запасных частей для самого себя. Для создания настоящих клонов есть отдельный термин — репродуктивное клонирование, и как раз оно сейчас запрещено.
Но даже если бы кто-нибудь сегодня отважился клонировать человека по методу Яманаки, ему все равно не удалось бы обойтись одной-единственной клеткой оригинала. Подобно тому, как клеточному ядру для развития было необходимо попасть в «тело» яйцеклетки, эмбриональные (и в том числе репрограммированные) клетки не могут расти без внезародышевых оболочек — амниона, аллантоиса и плаценты. Они нужны, чтобы прикрепить будущий зародыш к стенке матки, снабжать его едой и кислородом, а главное — сигналами о том, где у него, например, верхняя и нижняя сторона. Лишенные этой информации клетки зародыша вынуждены лепить из себя будущее существо вслепую — и у них никогда не получается принять форму эмбриона человека.
Поэтому репрограммированные клетки пришлось бы подсадить в уже существующий эмбрион на стадии бластоцисты, когда внезародышевые клетки уже образовали клеточный шар. В результате у вас получился бы гибрид: внезародышевые ткани от одного организма, а зародыш — от другого. Эта конструкция больше похожа на то, что происходит в фильме «Чужой: Воскрешение», когда клон Эллен Рипли раз за разом вырастает химерой, из которой не получается отделить гены Чужого. Насколько «скрещивание» эмбрионов сказалось бы на генетической идентичности человеческого клона мы, к счастью, не знаем — но допускаем, что чужеродная ДНК могла бы попасть внутрь зародышевых клеток. И неизвестно, удалось бы тогда ее отделить от собственных генов клона.
Как сделать гхолу
Клоны, которых мы могли бы создавать по методу Гердона или Яманаки, были бы «несамостоятельными». Биоматериала, забранного у оригинала, не хватало бы на то, чтобы вырастить полноценную копию. Чтобы реализовать предсказание Герберта, не хватало следующего шага: научиться превращать одну клетку взрослого организма в несколько типов клеток сразу — зародышевые и внезародышевые — и склеивать их в единую конструкцию.
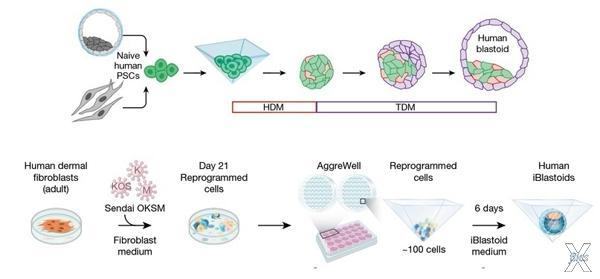
Первым эту проблему решил в 2019 году испанский биолог Хуан Карлос Исписуа Бельмонте, известный своими смелыми экспериментами (среди других его заслуг, например, создание химерных зародышей человека и обезьяны). Он брал клетку из организма взрослой мыши, репрограммировал ее, размножал и получал культуру зародышевых стволовых клеток. Затем он репрограммировал их еще «дальше», откатывая к состоянию, когда из клетки может получиться или зародыш, или внезародышевая ткань. А потом на культуру таких клеток действовал смесью сигнальных веществ: одни заставляли клетки стать зародышевыми, а другие — внезародышевыми. Получалась смесь, из которой вырастало нечто, похожее на бластоцисту — бластоид — и его даже удавалось имплантировать в мышиную матку. Так у Бельмонте сложился третий способ клонирования животных.
Теперь его успехи удалось повторить и с клетками людей. Причем это сделали одновременно сразу три группы. Исследователи из Австралии и Техаса опубликовали свое отчеты в новом номере Nature, а ученые из Калифорнийского технологического университета пока только выложили препринт на портал biorXiv — зато успели на несколько дней раньше.
Варианты создания бластоидов. Сверху - репрограммировать клетки в один и тот же тип, а затем собирать бластоид поэтапно. Снизу - репрограммировать клетки в несколько типов, а затем собрать бластоид в один шаг
Их методы незначительно различаются между собой, но в основе их одна и та же идея: репрограммировать клетки, подействовать на них разными сигнальными веществами и собрать в бластоид на трехмерной подложке. У всех исследовательских групп получились конструкции, которые по морфологии и экспрессии генов напоминали человеческие бластоцисты. А поскольку проверять их жизнеспособность имплантацией в матку запрещено законом, ученым пришлось имитировать имплантацию in vitro — это, конечно, еще не аксолотль-чаны Бене Тлейлаксу, но логика та же.
На этом месте в экспериментах с зародышами возникают неизбежные трудности: их нельзя культивировать дальше 14-го дня развития (о том, почему это так, мы подробно рассказывали в материале «14 дней спустя»). А поскольку бластоид — это не настоящая бластоциста, то не очень понятно, какому дню развития он соответствует и в какой момент стоит остановить эксперимент. Поэтому обе группы продержали свои бластоиды в течение трех-четырех дней после имплантации и завершили эксперимент. Однако они успели заметить, что их искусственные эмбрионы проходят примерно те же стадии развития, которые положено пройти настоящим зародышам в утробе матери.
Как и положено свежей технологии, «тлейлаксианский» метод клонирования пока выглядит довольно сырым. Бластоиды получаются не каждый раз, в них не всегда появляются все необходимые типы клеток, а их геометрию непросто контролировать. Наконец, пока не родилась даже первая мышь, клонированная новым способом — что уж говорить о человеке. Тем не менее, у разработчиков большие планы на будущее. Они обещают отточить технологию до такой степени, чтобы бластоиды стали идентичны человеческим бластоцистам (и на них можно было, например, изучать последствия генетической модификации) — и прозрачно намекают: создание таких зародышей потребует пересмотра нынешнего законодательства об экспериментах над эмбрионами.
Это законодательство и без того нуждается в пересмотре, и Международное общество исследования стволовых клеток обещает опубликовать новую версию рекомендаций этой весной. Однако, как отмечают авторы редакционной заметки в Nature, эксперименты над искусственными эмбрионами могут вызывать меньше сочувствия публики, чем манипуляции с настоящими зародышами — хотя, если по строению они окажутся идентичны, у них будут точно так же биться сердца, двигаться диафрагма и передаваться нервные импульсы. Придется ли для них прописывать отдельные правила или ученые договорятся обращаться со всеми эмбрионами одинаково, вне зависимости от их происхождения?
Когда Пол Атрейдес впервые встречается с гхолой своего погибшего друга и учителя Дункана Айдахо, он колеблется. Перед ним стоит не Айдахо, но его тело. В долгу ли он перед искусственно созданной плотью, «в которой ложь мешается с истиной»? Сегодня, когда мы вплотную приблизились к созданию того, что могло бы быть настоящим гхолой, вопрос о том, что намешано в плоти, встает и перед нами. И по мере того, как методы клонирования будут совершенствоваться, нам придется пересматривать не только свое представление о том, где начинается неповторимость человека (которую уже не получится определять через сумму его генов), но о том, где начинается его жизнь — особенно тем из нас, кто отсчитывает ее от встречи сперматозоида с яйцеклеткой.
Опубликовано 30 марта 2021
| Комментариев 0 | Прочтений 1030
Ещё по теме...
Добавить комментарий
Из новостей
Периодические издания
Информационная рассылка: