Как отредактировать биосферу
Что произойдет, если человечество сможет без труда изменять геномы организмов в масштабах целых популяций и даже биологических видов? С легкой руки журналистов генный драйв представляется могущественной и крайне опасной технологией. Но так ли это на самом деле?
Можно считать, что все проявления жизни на планете одинаково прекрасны и имеют равные и неотъемлемые права на существование, но кого мы пытаемся обмануть? Есть организмы, смертельная опасность которых для человека очевидна, а вот полезность для кого-либо в природе, кроме них самих, вызывает сомнения.
Особенно это касается наших паразитов — их скорейшее вымирание можно считать одной из вожделенных задач человечества. Скажем, вирус натуральной оспы с 1977 года официально вымер, и никто по этому поводу особо не страдает. Вот бы повторить этот опыт ещt с какой-нибудь заразой! Например, с малярией. Каждый год эта болезнь, вызываемая одноклеточным паразитом Plasmodium falciparum, уносит жизни более 2,7 млн человек, делая своего эксклюзивного распространителя — комара рода Anopheles — самым смертоносным животным на планете. Технология генного драйва теоретически позволяет уничтожить всю мировую популяцию малярийных комаров или генно-модифицировать ее, сделав невозможным перенос плазмодия. Как результат — плазмодий лишается единственного переносчика и вымирает. Мир свободен от малярии, все счастливы. Или все-таки нет?
Упоминания о генном драйве все чаще появляются в заголовках новостей. Одновременно самые серьезные правительственные учреждения мира продолжают тратить целые бюджеты на исследования безопасности этой нашумевшей технологии. Действительно, на первый взгляд ученые получили в руки эдакие садовые ножницы, которыми при необходимости можно уверенно обрезать особенно надоевшие нам ветки древа жизни. Но давайте обо всем по порядку.
Изначально генный драйв был предложен в начале 2000-х под впечатлением от еще совсем недавно открытых «наводящихся эндонуклеаз» (homing endonuclease) Эти ферменты, как и положено любой порядочной эндонуклеазе, режут двойную цепь ДНК на чётко обозначенном участке. А сам ген находится внутри такого же участка, ровно посередине — справа и слева от него лежат половинки последовательности, разрезаемой им (запомним этот факт). Когда клетка поймет, что в ее ДНК многовато дырок, включится клеточная система репарации (восстановления) двойных разрывов. Разрыв «застраивается» нуклеотидами по шаблону, в качестве которого берется максимально похожий участок ДНК. А самым похожим участком окажется фрагмент ДНК с геном «наводящейся эндонуклеазы» — вспомним какими последовательностями он окружен. Так система репарации клетки сама же встраивает ген эндонуклеазы в новое место.
Ген, не обремененный никакими полезными для организма функциями, успешно копирует себя, поэтому такой эгоизм поддерживается отбором на уровне генов. Вместе с тем вред, который этот ген-паразит причиняет своему организму-носителю, столь незначителен, что никак не штрафуется естественным отбором на уровне особи. Короче, эгоистичное поведение генов «наводящихся экзонуклеаз» полностью следует всем заветам Ричарда Докинза, а их тяга к поиску нового адреса прописки и дала им название «наводящиеся».
Но самое главное для нас не сам факт безобразного эгоизма генов, а то, что механизм репарации, как правило, встраивает эти гены на гомологичную хромосому. Из школьного курса биологии мы, если постараемся, обязательно вспомним, что хромосомы у нас (как и всех диплоидных организмов) парные не просто так. Одна из них досталась нам от папы, а другая от мамы, и набор генов в них одинаковый, разве что сами эти гены могут быть представлены разными вариантами (аллелями). Нужна такая хитроумная конструкция не только для красоты, а в основном (хотя и не только) для удобства работы уже упомянутой системы ремонта ДНК: если из ДНК был потерян небольшой кусок — не беда, его всегда можно восстановить, взяв за образец вторую гомологичную хромосому из пары. И именно в эту вторую, гомологичную хромосому будет вписываться наш ген «наводящейся эндонуклеазы».
А теперь вспомним менделевские законы наследования. Когда от мамы и от папы мы получили разные формы (аллели) одного и того же гена, каждый из них будет наследоваться следующему поколению с вероятностью 50% (½). Но только если речь не идет о «наводящейся эндонуклеазе». Доставшись от одного из родителей, этот наглый ген тут же найдет себе место и на соседней, гомологичной хромосоме. А значит, все 100% потомков станут его обладателями. Такая же картина повторится в следующем поколении. Эгоистичный ген будет стремительно распространяться по популяции.
В 2003 году Остин Берт предложил использовать это свойство ушлого гена во благо человечества. А именно — для направленного уничтожения надоевших нам биологических видов. В теории этот сценарий подходит для любого организма, размножающегося половым путем. Представим, что методами генной инженерии мы изменяем специфичность нашей эгоистичной эндонуклеазы и заставляем ее наглый ген ненавязчиво влезать прямо в центр какого-нибудь безумно важного для размножения гена. Понятно, что это тут же его сломает. При этом важно, чтобы поломка этого гена вызывала стерильность только у одного пола — ведь должен же его кто-то распространять? Пусть, например, наша эгоистичная нуклеаза будет вызывать бесплодие у самок, тогда передавать ее другим поколениям будут самцы. С каждым поколением доля самцов-носителей и бесплодных самок будет увеличиваться, пока наконец в популяции не останутся лишь они одни. Это поколение и станет последним. Вроде бы все прекрасно! Но нет, оказалось, что жизнь далека от этого сценария.
Приучить эгоистичную нуклеазу распознавать именно нужные нам последовательности в генах комара оказалось не таким простым делом, поэтому технология могла так и остаться лишь смелым планом (pdf). Если бы не грянула очередная революция — открытие системы CRISPR-CAS9.
Не будем останавливаться на ней слишком подробно — благо, о ней и так написано немало. Но здорово осознавать, что эта система, созданная эволюцией сотни миллионов лет назад как аналог иммунитета у бактерий, — настоящее воплощение модного нынче принципа модульности. Нуклеаза CAS9 чем-то похожа на высокоточную ракету, ведомую своеобразным модулем наведения — специальной молекулой «гидовой» РНК. Если эта РНК села на цепь ДНК, этот участок ДНК обязательно будет разрезан нуклеазой. При этом последовательность самой «гидовой» РНК может быть практически любой, а значит, и навести нашу нуклеазу можно куда угодно.
Эти фантастические свойства системы и были использованы в новых концепциях генного драйва. Остальной сценарий нам уже знаком: половинки разрезаемого фрагмента окружают блок из тех генов, которые нужно «задрайвить» в популяцию. И здесь снова включается принцип модульности: мы можем «драйвить» практически любой ген, собирая блок из гена CAS9, гена «гидовой» РНК и практически любого гена (или генов!) целевой нагрузки, который мы хотим внести в нашу популяцию.
То есть для успеха коварного плана по искоренению малярии комаров даже не нужно стерилизовать! Можно, например, распространить в их популяции гены антител к малярийному плазмодию — и слюнные железы комаров навсегда перестанут быть уютным домом для этих паразитов. При этом, в идеале, для запуска волнообразного распространения генной модификации хватит единственного выпущенного на свободу ГМО-комарика. Для такой реакции ученые даже выдумали красивое название — мутагенная цепная реакция.
Но не слишком ли далеко мы зашли? Здравый смысл подсказывает, что в жизни все очень часто идет не по плану, а воображение быстро находит аналогию с ящиком Пандоры. Действительно, генный драйв, модифицирующий популяцию, легко распространяется и на весь биологический вид. Он необратим, а о его последствиях можно с уверенностью сказать, лишь поставив эксперимент в живой природе. Ученые оказываются буквально зажаты в порочном кругу из неприемлемых рисков. Мало того, получается, что побег из лаборатории даже одиночного генно-модифицированного животного с «драйвовыми» генами потенциально может привести к самым непредсказуемым последствиям. А уж какой тут простор для биотерроризма! Осознание этих простых истин пришло практически мгновенно, поэтому последние годы на западных исследователей, занимающихся изучением безопасности генного драйва, проливается настоящий дождь из государственных грантов.
И нужно сказать, что первые итоги их исследований успокаивают. Конец света опять отменяется. Математическое моделирование и лабораторные опыты показывают, что организмы способны довольно быстро вырабатывать устойчивость к генному драйву за счет мутаций в участках распознавания нуклеазы. В популяции достаточного размера всегда найдутся особи, обладающие устойчивым к драйву генотипом. Чем вреднее гены, которые мы насаждаем, тем быстрее будет распространяться устойчивость. И наоборот, если вредность гена не стоит затрат на приобретение устойчивости, устойчивость практически не проявляется. Другое, недавнее моделирование показывает, что ген может успешно «драйвить» в популяцию, только если его адаптивная цена не будет слишком большой. Да и количество ГМО-особей, необходимых для успешного запуска цепной мутагенной реакции, сильно зависит от «вредности» вносимого гена и измеряется уж никак не штуками.
Так что, судя по всему, предположения об опасности генного драйва изрядно преувеличены. Более того, оказывается само успешное внесение гена в популяцию требует борьбы с устойчивостью популяции к этому внесению. Так, например, последние исследования предлагают использовать для этого целый набор различных «гидовых» РНК, которые будут наводить нуклеазу CAS9 на несколько независимых целей в геноме. Чем больше разных РНК используется, тем больший охват популяции мы получим даже при внесении «вредных» генов.
Между тем группа сотрудников Массачусетского технологического института предложила оригинальный механизм ограничения генного драйва. Он получил название daisy-chain — «цветочная гирлянда». В ней предлагается разнести необходимые для драйва элементы на разные хромосомы. Например, так: два из этих трех изолированных элементов — целевой вносимый ген и ген гидовой РНК — остаются окруженными повторами и «драйвят» с помощью нуклеазы, а третий ген — ген этой самой нуклеазы CAS9, необходимой для драйва, сам к драйву не способен и передается по традиционным менделевским законам. В итоге генный драйв есть, но он строго ограничен числом носителей третьего гена, играющего по менделевским правилам. Теперь любой драйв зависит от него. Если драйв имеет какую-то адаптивную цену, он распространяется лишь ограниченное число поколений, а затем исчезает, потому что напрочь лишенный «эгоизма» третий ген очень быстро удаляется естественным отбором.
Теперь в ближайших планах авторов «гирлянды» — обкатка метода в дикой природе на микроскопических круглых червях нематодах. Между тем британская фирма Oxitec уже более двух лет ведет проект по снижению численности малярийных комаров в окрестностях города Эльдорадо в Бразилии. Правда, при этом применяется несколько урезанная версия генного драйва: фирма производит, а затем выпускает на свободу генно-модифицированных комаров-самцов. Спариваясь с дикими самками, подсадные комарики производят нежизнеспособное потомство, эффективно снижая численность собратьев по виду (по утверждению самой фирмы — более чем на 90%). Одновременно, из-за быстрой гибели потомства ГМО-особей, гены просто не получают возможности распространиться и цепной мутагенной реакции не происходит.
Ну и напоследок нельзя не вспомнить о Новой Зеландии. Пожалуй, эта страна знает больше всего о цене необдуманного вторжения в дела природы. Но тем не менее новозеландские экологи возлагают огромные надежды на генный драйв. На островах ведется скрупулезная подготовка к реализации одного из самых амбициозных экологических проектов в истории — Predator Free 2050. Само название как бы намекает на то, что до середины текущего столетия новозеландские экологи планируют полностью избавиться от хищников, обильно понаехавших на острова вместе с людьми за предыдущую тысячу лет. Возможно, именно здесь генный драйв впервые будет опробован на млекопитающих, в первую очередь — грызунах, которые уже не одну сотню лет кошмарят местных какапо, кудлатых киви и прочих гигантантских уэт.
Разумный скепсис, тревоги и сомнения всегда должны сопровождать любое вмешательство в природу. Но, по правде говоря, наш биологический вид на протяжении всей своей истории грубо менял эту природу под себя, не особо разбираясь в средствах. Так уж мы устроены. Но времена меняются, и, возможно, столь мощные биотехнологии, как генный драйв, наконец-то помогут нам перейти от грубой ломки биосферы к ее аккуратному обустройству и мягкой, разумной подстройке под свои потребности.Источник: Чердак
Можно считать, что все проявления жизни на планете одинаково прекрасны и имеют равные и неотъемлемые права на существование, но кого мы пытаемся обмануть? Есть организмы, смертельная опасность которых для человека очевидна, а вот полезность для кого-либо в природе, кроме них самих, вызывает сомнения.
Особенно это касается наших паразитов — их скорейшее вымирание можно считать одной из вожделенных задач человечества. Скажем, вирус натуральной оспы с 1977 года официально вымер, и никто по этому поводу особо не страдает. Вот бы повторить этот опыт ещt с какой-нибудь заразой! Например, с малярией. Каждый год эта болезнь, вызываемая одноклеточным паразитом Plasmodium falciparum, уносит жизни более 2,7 млн человек, делая своего эксклюзивного распространителя — комара рода Anopheles — самым смертоносным животным на планете. Технология генного драйва теоретически позволяет уничтожить всю мировую популяцию малярийных комаров или генно-модифицировать ее, сделав невозможным перенос плазмодия. Как результат — плазмодий лишается единственного переносчика и вымирает. Мир свободен от малярии, все счастливы. Или все-таки нет?
Упоминания о генном драйве все чаще появляются в заголовках новостей. Одновременно самые серьезные правительственные учреждения мира продолжают тратить целые бюджеты на исследования безопасности этой нашумевшей технологии. Действительно, на первый взгляд ученые получили в руки эдакие садовые ножницы, которыми при необходимости можно уверенно обрезать особенно надоевшие нам ветки древа жизни. Но давайте обо всем по порядку.
Изначально генный драйв был предложен в начале 2000-х под впечатлением от еще совсем недавно открытых «наводящихся эндонуклеаз» (homing endonuclease) Эти ферменты, как и положено любой порядочной эндонуклеазе, режут двойную цепь ДНК на чётко обозначенном участке. А сам ген находится внутри такого же участка, ровно посередине — справа и слева от него лежат половинки последовательности, разрезаемой им (запомним этот факт). Когда клетка поймет, что в ее ДНК многовато дырок, включится клеточная система репарации (восстановления) двойных разрывов. Разрыв «застраивается» нуклеотидами по шаблону, в качестве которого берется максимально похожий участок ДНК. А самым похожим участком окажется фрагмент ДНК с геном «наводящейся эндонуклеазы» — вспомним какими последовательностями он окружен. Так система репарации клетки сама же встраивает ген эндонуклеазы в новое место.
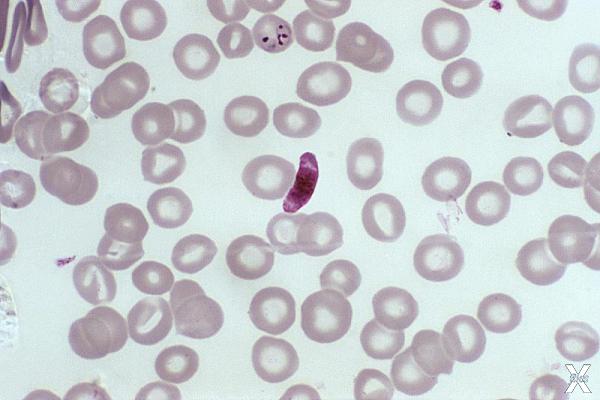
Микрогаметоцит паразита Plasmodium falciparum в мазке крови. Микрофотография: Dr. Mae Melvin / CDC / Public Domain
Ген, не обремененный никакими полезными для организма функциями, успешно копирует себя, поэтому такой эгоизм поддерживается отбором на уровне генов. Вместе с тем вред, который этот ген-паразит причиняет своему организму-носителю, столь незначителен, что никак не штрафуется естественным отбором на уровне особи. Короче, эгоистичное поведение генов «наводящихся экзонуклеаз» полностью следует всем заветам Ричарда Докинза, а их тяга к поиску нового адреса прописки и дала им название «наводящиеся».
Но самое главное для нас не сам факт безобразного эгоизма генов, а то, что механизм репарации, как правило, встраивает эти гены на гомологичную хромосому. Из школьного курса биологии мы, если постараемся, обязательно вспомним, что хромосомы у нас (как и всех диплоидных организмов) парные не просто так. Одна из них досталась нам от папы, а другая от мамы, и набор генов в них одинаковый, разве что сами эти гены могут быть представлены разными вариантами (аллелями). Нужна такая хитроумная конструкция не только для красоты, а в основном (хотя и не только) для удобства работы уже упомянутой системы ремонта ДНК: если из ДНК был потерян небольшой кусок — не беда, его всегда можно восстановить, взяв за образец вторую гомологичную хромосому из пары. И именно в эту вторую, гомологичную хромосому будет вписываться наш ген «наводящейся эндонуклеазы».
А теперь вспомним менделевские законы наследования. Когда от мамы и от папы мы получили разные формы (аллели) одного и того же гена, каждый из них будет наследоваться следующему поколению с вероятностью 50% (½). Но только если речь не идет о «наводящейся эндонуклеазе». Доставшись от одного из родителей, этот наглый ген тут же найдет себе место и на соседней, гомологичной хромосоме. А значит, все 100% потомков станут его обладателями. Такая же картина повторится в следующем поколении. Эгоистичный ген будет стремительно распространяться по популяции.
В 2003 году Остин Берт предложил использовать это свойство ушлого гена во благо человечества. А именно — для направленного уничтожения надоевших нам биологических видов. В теории этот сценарий подходит для любого организма, размножающегося половым путем. Представим, что методами генной инженерии мы изменяем специфичность нашей эгоистичной эндонуклеазы и заставляем ее наглый ген ненавязчиво влезать прямо в центр какого-нибудь безумно важного для размножения гена. Понятно, что это тут же его сломает. При этом важно, чтобы поломка этого гена вызывала стерильность только у одного пола — ведь должен же его кто-то распространять? Пусть, например, наша эгоистичная нуклеаза будет вызывать бесплодие у самок, тогда передавать ее другим поколениям будут самцы. С каждым поколением доля самцов-носителей и бесплодных самок будет увеличиваться, пока наконец в популяции не останутся лишь они одни. Это поколение и станет последним. Вроде бы все прекрасно! Но нет, оказалось, что жизнь далека от этого сценария.
Приучить эгоистичную нуклеазу распознавать именно нужные нам последовательности в генах комара оказалось не таким простым делом, поэтому технология могла так и остаться лишь смелым планом (pdf). Если бы не грянула очередная революция — открытие системы CRISPR-CAS9.
Не будем останавливаться на ней слишком подробно — благо, о ней и так написано немало. Но здорово осознавать, что эта система, созданная эволюцией сотни миллионов лет назад как аналог иммунитета у бактерий, — настоящее воплощение модного нынче принципа модульности. Нуклеаза CAS9 чем-то похожа на высокоточную ракету, ведомую своеобразным модулем наведения — специальной молекулой «гидовой» РНК. Если эта РНК села на цепь ДНК, этот участок ДНК обязательно будет разрезан нуклеазой. При этом последовательность самой «гидовой» РНК может быть практически любой, а значит, и навести нашу нуклеазу можно куда угодно.
Эти фантастические свойства системы и были использованы в новых концепциях генного драйва. Остальной сценарий нам уже знаком: половинки разрезаемого фрагмента окружают блок из тех генов, которые нужно «задрайвить» в популяцию. И здесь снова включается принцип модульности: мы можем «драйвить» практически любой ген, собирая блок из гена CAS9, гена «гидовой» РНК и практически любого гена (или генов!) целевой нагрузки, который мы хотим внести в нашу популяцию.
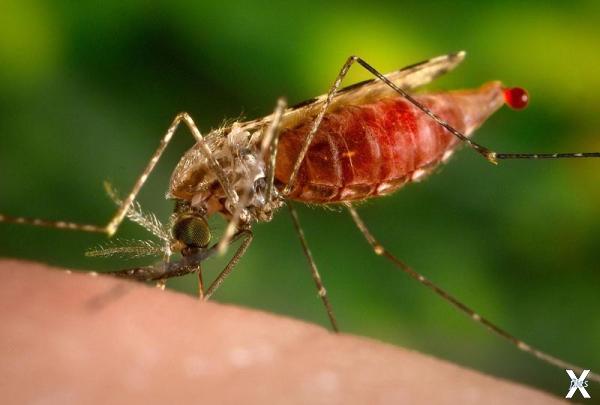
Самка комара Anopheles quadriannulatus. Фото: James Gathany / CDC / Public Domain
То есть для успеха коварного плана по искоренению малярии комаров даже не нужно стерилизовать! Можно, например, распространить в их популяции гены антител к малярийному плазмодию — и слюнные железы комаров навсегда перестанут быть уютным домом для этих паразитов. При этом, в идеале, для запуска волнообразного распространения генной модификации хватит единственного выпущенного на свободу ГМО-комарика. Для такой реакции ученые даже выдумали красивое название — мутагенная цепная реакция.
Но не слишком ли далеко мы зашли? Здравый смысл подсказывает, что в жизни все очень часто идет не по плану, а воображение быстро находит аналогию с ящиком Пандоры. Действительно, генный драйв, модифицирующий популяцию, легко распространяется и на весь биологический вид. Он необратим, а о его последствиях можно с уверенностью сказать, лишь поставив эксперимент в живой природе. Ученые оказываются буквально зажаты в порочном кругу из неприемлемых рисков. Мало того, получается, что побег из лаборатории даже одиночного генно-модифицированного животного с «драйвовыми» генами потенциально может привести к самым непредсказуемым последствиям. А уж какой тут простор для биотерроризма! Осознание этих простых истин пришло практически мгновенно, поэтому последние годы на западных исследователей, занимающихся изучением безопасности генного драйва, проливается настоящий дождь из государственных грантов.
И нужно сказать, что первые итоги их исследований успокаивают. Конец света опять отменяется. Математическое моделирование и лабораторные опыты показывают, что организмы способны довольно быстро вырабатывать устойчивость к генному драйву за счет мутаций в участках распознавания нуклеазы. В популяции достаточного размера всегда найдутся особи, обладающие устойчивым к драйву генотипом. Чем вреднее гены, которые мы насаждаем, тем быстрее будет распространяться устойчивость. И наоборот, если вредность гена не стоит затрат на приобретение устойчивости, устойчивость практически не проявляется. Другое, недавнее моделирование показывает, что ген может успешно «драйвить» в популяцию, только если его адаптивная цена не будет слишком большой. Да и количество ГМО-особей, необходимых для успешного запуска цепной мутагенной реакции, сильно зависит от «вредности» вносимого гена и измеряется уж никак не штуками.
Так что, судя по всему, предположения об опасности генного драйва изрядно преувеличены. Более того, оказывается само успешное внесение гена в популяцию требует борьбы с устойчивостью популяции к этому внесению. Так, например, последние исследования предлагают использовать для этого целый набор различных «гидовых» РНК, которые будут наводить нуклеазу CAS9 на несколько независимых целей в геноме. Чем больше разных РНК используется, тем больший охват популяции мы получим даже при внесении «вредных» генов.
Между тем группа сотрудников Массачусетского технологического института предложила оригинальный механизм ограничения генного драйва. Он получил название daisy-chain — «цветочная гирлянда». В ней предлагается разнести необходимые для драйва элементы на разные хромосомы. Например, так: два из этих трех изолированных элементов — целевой вносимый ген и ген гидовой РНК — остаются окруженными повторами и «драйвят» с помощью нуклеазы, а третий ген — ген этой самой нуклеазы CAS9, необходимой для драйва, сам к драйву не способен и передается по традиционным менделевским законам. В итоге генный драйв есть, но он строго ограничен числом носителей третьего гена, играющего по менделевским правилам. Теперь любой драйв зависит от него. Если драйв имеет какую-то адаптивную цену, он распространяется лишь ограниченное число поколений, а затем исчезает, потому что напрочь лишенный «эгоизма» третий ген очень быстро удаляется естественным отбором.
Теперь в ближайших планах авторов «гирлянды» — обкатка метода в дикой природе на микроскопических круглых червях нематодах. Между тем британская фирма Oxitec уже более двух лет ведет проект по снижению численности малярийных комаров в окрестностях города Эльдорадо в Бразилии. Правда, при этом применяется несколько урезанная версия генного драйва: фирма производит, а затем выпускает на свободу генно-модифицированных комаров-самцов. Спариваясь с дикими самками, подсадные комарики производят нежизнеспособное потомство, эффективно снижая численность собратьев по виду (по утверждению самой фирмы — более чем на 90%). Одновременно, из-за быстрой гибели потомства ГМО-особей, гены просто не получают возможности распространиться и цепной мутагенной реакции не происходит.
Ну и напоследок нельзя не вспомнить о Новой Зеландии. Пожалуй, эта страна знает больше всего о цене необдуманного вторжения в дела природы. Но тем не менее новозеландские экологи возлагают огромные надежды на генный драйв. На островах ведется скрупулезная подготовка к реализации одного из самых амбициозных экологических проектов в истории — Predator Free 2050. Само название как бы намекает на то, что до середины текущего столетия новозеландские экологи планируют полностью избавиться от хищников, обильно понаехавших на острова вместе с людьми за предыдущую тысячу лет. Возможно, именно здесь генный драйв впервые будет опробован на млекопитающих, в первую очередь — грызунах, которые уже не одну сотню лет кошмарят местных какапо, кудлатых киви и прочих гигантантских уэт.
Уэта Deinacrida rugosa. Фото: d_kluza / inaturalist.org / CC BY-NC-ND 4.0
Разумный скепсис, тревоги и сомнения всегда должны сопровождать любое вмешательство в природу. Но, по правде говоря, наш биологический вид на протяжении всей своей истории грубо менял эту природу под себя, не особо разбираясь в средствах. Так уж мы устроены. Но времена меняются, и, возможно, столь мощные биотехнологии, как генный драйв, наконец-то помогут нам перейти от грубой ломки биосферы к ее аккуратному обустройству и мягкой, разумной подстройке под свои потребности.Источник: Чердак
Опубликовано 25 сентября 2017
Комментариев 0 | Прочтений 2817
Ещё по теме...
Добавить комментарий
Из новостей
Периодические издания
Информационная рассылка: