Необратимая энтропия – что ты такое?
Возможно, каждый из нас задумывался о том, что все процессы на Земле носят необратимый характер. Например, человек, как бы он ни хотел быть молодым, даже несмотря на пластические операции, рано или поздно состарится, и организм его – экая хитрая и замудрённая система приходит в негодность. Цветы, радующие глаз своими яркими красками, тоже со временем увядают. Даже если мы купим новый велосипед и не будем на нём ездить, то он не сохранится на века в своём безупречном состоянии. Иными словами, как бы мы не стремились что-то спасти, всё равно оно приходит в негодность. Почему время всегда идёт вперёд, а не назад? И раз уж все мы смертные, то что же будет со Вселенной, что ждёт её в итоге? Ответить на эти вопросы поможет одно из самых сложных понятий в современной науке – энтропия. Попробуем разобраться!
Энтропия – это величайшая сила во Вселенной, которую мы видим каждый день. Примером её может быть что угодно, начиная от разбитой кружки и заканчивая взорвавшейся звездой.
Энтропия играет в жизни нашей Вселенной огромную роль. Именно она лежит в основе второго закона термодинамики. Помните его из школьного курса физики? Есть несколько формулировок данного закона, которые объясняют одну правду различными способами. Первый, кто сформулировал его, это Р. Клаузиус, затем последовали формулировки Томсона, Больцмана, Кельвина. Различные интерпретации этого закона позволяют его понять лучше. Они перед вами:
1. Переход тепла от тела с невысокой температурой к другому телу с более высоким уровнем температуры невозможен. (Клаузиус)
2. Любой процесс является невозможным, если для его осуществления должно использоваться тепло взятое от постороннего тела. (Томсон)
3. Состояние энтропии не может стать меньше в полностью закрытых системах, которые не получают никакую внешнюю энергию. (Больцман)
4. Периодические процессы, происходящие исключительно за счет теплоты единого источника, являются невозможными. Создание вечного теплового двигателя, который совершал бы механические процессы за счет потери тепла любого тела, является невозможным. (Кельвин).
Какой можно сделать из этого вывод совсем простым языком? Тепло переходит самопроизвольно только от горячего тела к холодному. Обратно такая штука не работает для замкнутых систем, в которых нет энергообмена с окружающей средой. Нет такого процесса, в котором тепло самопроизвольно перейдёт от холодного к горячему. Для существования такого процесса придётся выполнить работу извне, то есть, сделать систему незамкнутой, исключив самопроизвольность. Энтропия – это как раз та самая величина, которая характеризует передачу энергии внутри системы. В случае передачи тепла от горячего к холодному энтропия увеличивается, а в обратном – уменьшается. В изолированной системе энтропия не может уменьшаться (точно так же, как холодное не может нагреть горячее). Попробуйте бросить кубик льда в горячий чай – кубик льда, разумеется, не нагреет напиток.
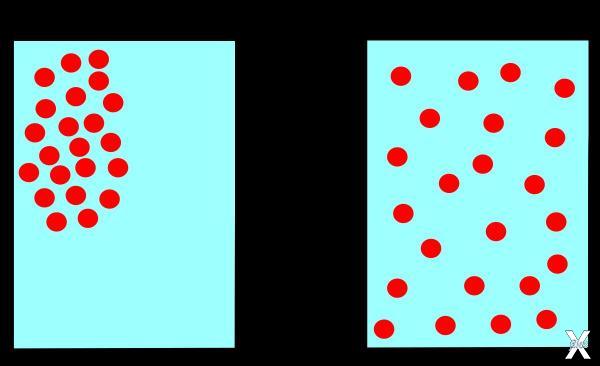
В нашем мире энтропия замкнутой системы всегда увеличивается, причём, она постоянно стремится достичь состояния максимума, как бы вы ей не сопротивлялись: да, её можно замедлить, например, редко кататься на новом велосипеде, но всё же, как бы вы его не берегли, его не сохранишь в первозданном виде. Когда энтропия достигает максимума, состояние становится равновесным, а к равновесному состоянию замкнутая система стремится сама, как та самая остывшая чашка чая, или спущенное колесо нового велосипеда, который вы спрятали.
Возвращаясь к примеру с велосипедом, можно сделать вывод, что, чем более динамичная система, тем быстрее она приходит к состоянию хаоса. Поэтому энтропию иногда называют мерой беспорядка, но всё же это не совсем верно. Например, что находится в состоянии бОльшего беспорядка: стакан с колотыми кусочками льда или стакан воды? Многие ответят, что больше беспорядка в стакане со льдом, но на самом деле его энтропия меньше. Лёд тает, колесо спускает, так как энергия распределяется равномернее, чем в своих изначальных состояниях.
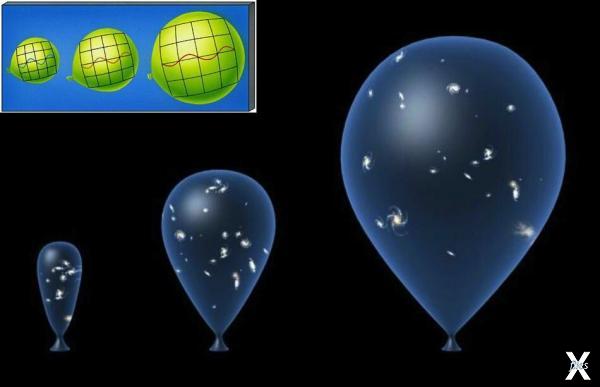
Если мы возьмём ещё один простой пример: представьте резервуар из двух полостей, разделённых перегородкой. В одной полости есть молекулы газа. Если вы уберёте перегородку, часть молекул газа перейдут во вторую полость, и, таким образом, вещество распределится равномерно – так установится равновесие в системе с максимальной энтропией, и произойдёт это самопроизвольно. То же самое происходит и со Вселенной: галактики, подобно молекулам газа, постоянно «разбегаются», то есть равномерно распределяются в пространстве. Но энтропия закрытой системы всегда растёт, а закрытая система – это та система, которая ни с чем не взаимодействует.
Получается, что наша Вселенная, исходя из этого, является замкнутой. Изначально всё вещество Вселенной было сжато в сверхплотной точке, как газ в резервуаре. Когда произошёл Большой взрыв, вещество начало распределяться в пространстве. В закрытом резервуаре у молекул газа было меньше свободы, а, значит, меньше возможных состояний, ведь их свобода была ограничена. Так же и в момент рождения Вселенной, когда всё вещество было сжато в сверхплотной точке. Когда молекулы газа «выпустили» (то есть, убрали перегородку), у них появилось больше свободы, а значит, больше возможных состояний, и энтропия, соответственно, выше. Процессы, в которых энтропия увеличивается, называются необратимыми.
Почему процессы необратимы? Молекулы газа, выпущенные из резервуара, вряд ли столкнутся так, что снова соберутся в своём углу, где их закрыли изначально. Процесс необратим, так как мы перешли от меньшего количество состояний в меньшем объёме к большему количеству возможных состояний. Это же происходит и во Вселенной.
Изначально она, как и стакан чая, была горячая (правда, температуру не сравнишь, конечно, температура горячего чая – около 70 С, а горячей Вселенной в сингулярности – миллиарды градусов), но и в том и в другом случае происходит постепенное остывание.
Причём тут тепло?! – возможно, подумаете вы. Это легко можно представить на простом примере. Возьмём бильярдный шар и оттолкнём его в сторону другого бильярдного шара. Первый шар передаст ему импульс. На первый взгляд этот процесс обратим. Второй шар можно оттолкнуть назад так, чтобы первый вернулся на место. Однако на микроскопическом уровне всё иначе. Удар вызовет нагревание. Часть молекул в шаре в результате столкновения перешла в более высокое энергетическое состояние, а также во время движения возникает трение о воздух и поверхность стола, и все эти молекулы невозможно будет вернуть в первоначальное состояние, поэтому в действительности энтропия в системе возросла. Поэтому, даже если нам кажется, что процесс обратим, то это иллюзия – энтропия хоть на немного, но возросла.
Таким образом, беспорядок, а вместе с ним и количество возможных состояний системы растёт с ростом взаимосвязей, а значительная часть взаимосвязей идёт от тепла, то есть каждое ваше действие генерирует тепло, которое рассеивается во Вселенную, и всё это на молекулярном уровне увеличивает энтропию Вселенной.Источник: "Астрономия с Ауриэль"
Энтропия – это величайшая сила во Вселенной, которую мы видим каждый день. Примером её может быть что угодно, начиная от разбитой кружки и заканчивая взорвавшейся звездой.
Энтропия играет в жизни нашей Вселенной огромную роль. Именно она лежит в основе второго закона термодинамики. Помните его из школьного курса физики? Есть несколько формулировок данного закона, которые объясняют одну правду различными способами. Первый, кто сформулировал его, это Р. Клаузиус, затем последовали формулировки Томсона, Больцмана, Кельвина. Различные интерпретации этого закона позволяют его понять лучше. Они перед вами:
1. Переход тепла от тела с невысокой температурой к другому телу с более высоким уровнем температуры невозможен. (Клаузиус)
2. Любой процесс является невозможным, если для его осуществления должно использоваться тепло взятое от постороннего тела. (Томсон)
3. Состояние энтропии не может стать меньше в полностью закрытых системах, которые не получают никакую внешнюю энергию. (Больцман)
4. Периодические процессы, происходящие исключительно за счет теплоты единого источника, являются невозможными. Создание вечного теплового двигателя, который совершал бы механические процессы за счет потери тепла любого тела, является невозможным. (Кельвин).
Какой можно сделать из этого вывод совсем простым языком? Тепло переходит самопроизвольно только от горячего тела к холодному. Обратно такая штука не работает для замкнутых систем, в которых нет энергообмена с окружающей средой. Нет такого процесса, в котором тепло самопроизвольно перейдёт от холодного к горячему. Для существования такого процесса придётся выполнить работу извне, то есть, сделать систему незамкнутой, исключив самопроизвольность. Энтропия – это как раз та самая величина, которая характеризует передачу энергии внутри системы. В случае передачи тепла от горячего к холодному энтропия увеличивается, а в обратном – уменьшается. В изолированной системе энтропия не может уменьшаться (точно так же, как холодное не может нагреть горячее). Попробуйте бросить кубик льда в горячий чай – кубик льда, разумеется, не нагреет напиток.
В нашем мире энтропия замкнутой системы всегда увеличивается, причём, она постоянно стремится достичь состояния максимума, как бы вы ей не сопротивлялись: да, её можно замедлить, например, редко кататься на новом велосипеде, но всё же, как бы вы его не берегли, его не сохранишь в первозданном виде. Когда энтропия достигает максимума, состояние становится равновесным, а к равновесному состоянию замкнутая система стремится сама, как та самая остывшая чашка чая, или спущенное колесо нового велосипеда, который вы спрятали.
Возвращаясь к примеру с велосипедом, можно сделать вывод, что, чем более динамичная система, тем быстрее она приходит к состоянию хаоса. Поэтому энтропию иногда называют мерой беспорядка, но всё же это не совсем верно. Например, что находится в состоянии бОльшего беспорядка: стакан с колотыми кусочками льда или стакан воды? Многие ответят, что больше беспорядка в стакане со льдом, но на самом деле его энтропия меньше. Лёд тает, колесо спускает, так как энергия распределяется равномернее, чем в своих изначальных состояниях.
Если мы возьмём ещё один простой пример: представьте резервуар из двух полостей, разделённых перегородкой. В одной полости есть молекулы газа. Если вы уберёте перегородку, часть молекул газа перейдут во вторую полость, и, таким образом, вещество распределится равномерно – так установится равновесие в системе с максимальной энтропией, и произойдёт это самопроизвольно. То же самое происходит и со Вселенной: галактики, подобно молекулам газа, постоянно «разбегаются», то есть равномерно распределяются в пространстве. Но энтропия закрытой системы всегда растёт, а закрытая система – это та система, которая ни с чем не взаимодействует.
Получается, что наша Вселенная, исходя из этого, является замкнутой. Изначально всё вещество Вселенной было сжато в сверхплотной точке, как газ в резервуаре. Когда произошёл Большой взрыв, вещество начало распределяться в пространстве. В закрытом резервуаре у молекул газа было меньше свободы, а, значит, меньше возможных состояний, ведь их свобода была ограничена. Так же и в момент рождения Вселенной, когда всё вещество было сжато в сверхплотной точке. Когда молекулы газа «выпустили» (то есть, убрали перегородку), у них появилось больше свободы, а значит, больше возможных состояний, и энтропия, соответственно, выше. Процессы, в которых энтропия увеличивается, называются необратимыми.
Почему процессы необратимы? Молекулы газа, выпущенные из резервуара, вряд ли столкнутся так, что снова соберутся в своём углу, где их закрыли изначально. Процесс необратим, так как мы перешли от меньшего количество состояний в меньшем объёме к большему количеству возможных состояний. Это же происходит и во Вселенной.
Изначально она, как и стакан чая, была горячая (правда, температуру не сравнишь, конечно, температура горячего чая – около 70 С, а горячей Вселенной в сингулярности – миллиарды градусов), но и в том и в другом случае происходит постепенное остывание.
Причём тут тепло?! – возможно, подумаете вы. Это легко можно представить на простом примере. Возьмём бильярдный шар и оттолкнём его в сторону другого бильярдного шара. Первый шар передаст ему импульс. На первый взгляд этот процесс обратим. Второй шар можно оттолкнуть назад так, чтобы первый вернулся на место. Однако на микроскопическом уровне всё иначе. Удар вызовет нагревание. Часть молекул в шаре в результате столкновения перешла в более высокое энергетическое состояние, а также во время движения возникает трение о воздух и поверхность стола, и все эти молекулы невозможно будет вернуть в первоначальное состояние, поэтому в действительности энтропия в системе возросла. Поэтому, даже если нам кажется, что процесс обратим, то это иллюзия – энтропия хоть на немного, но возросла.
Таким образом, беспорядок, а вместе с ним и количество возможных состояний системы растёт с ростом взаимосвязей, а значительная часть взаимосвязей идёт от тепла, то есть каждое ваше действие генерирует тепло, которое рассеивается во Вселенную, и всё это на молекулярном уровне увеличивает энтропию Вселенной.Источник: "Астрономия с Ауриэль"
Опубликовано 17 декабря 2021
Комментариев 0 | Прочтений 1310
Ещё по теме...
Добавить комментарий
Из новостей
Периодические издания
Информационная рассылка: